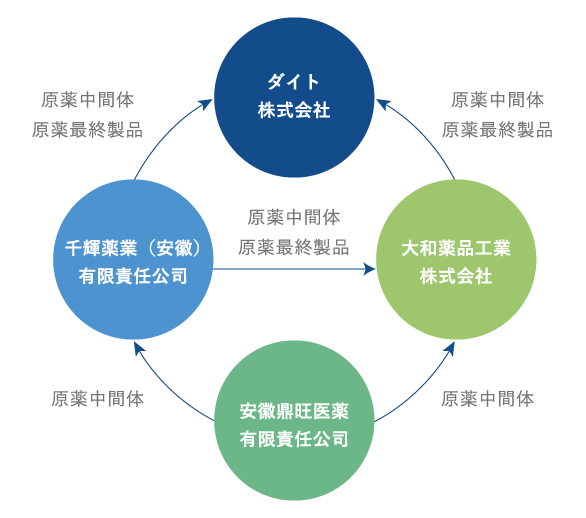
当社グループは国内2拠点、海外2拠点に原薬工場を有しております。
グループ内での生産体制の最適化による高い生産能力を備えており、低コスト・高品質の原薬を安定供給しております。
マスターファイル(MF)登録制度について
医薬品製造の承認には医薬品の製造方法について詳細な審査が必要になります。
平成14年改正薬事法(平成17年4月施行)以前は、医薬品の有効成分となる原薬製造と製剤メーカーが異なる場合、製剤メーカーの製剤の申請書に、原薬メーカーのノウハウや知的財産を含む原薬製造方法を記載して、製剤の申請を行う必要がありました。
平成14年改正薬事法にて、原薬メーカーのノウハウに関わる情報等の保護を目的として、審査に必要な情報のうち知的財産に関わる情報を開示することなく、承認審査を行なう制度が導入されました。これが、原薬等登録原簿(マスターファイル:MF)制度です。
マスターファイル登録は義務ではありませんが、ジェネリック医薬品用の原薬のように、複数社への販売を企図する場合には登録を行うことが一般的です。
当社グループではマスターファイルの登録件数が、グループ全体で106件(2025年5月末現在)と日本一であり、様々な原薬の製造に対応できる供給体制を構築しています。